Токсическое действие CO обусловлено образованием карбоксигемоглобина – гораздо более прочного карбонильного комплекса с гемоглобином, чем комплекс гемоглобин-кислород. Таким образом, блокируется перенос кислорода и клеточное дыхание. Концентрация в воздухе более 0,1 процента вызывает смерть в течение часа.
Монооксид углерода
Монооксид углерода (монооксид углерода, монооксид углерода, Моноксид углерода (II)) – это бесцветный, чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Его химическая формула – CO.
- 1 Молекулярная структура
- 2 Свойства
- 3 Физиологические эффекты
- 3.1 Токсичность
- 3.1.1 Помощь при отравлении угарным газом(II)
- 3.1.2 Защита от монооксида углерода(II)
- 5.1 Промышленный метод
- 5.2 Лабораторный метод
Молекулярная структура
Молекула CO имеет тройную связь, как и молекула азота N2. Поскольку эти молекулы имеют сходную структуру (изоэлектроны, дихатомы, сходная молярная масса), их свойства также сходны – очень низкие температуры плавления и кипения, сходные стандартные значения энтропии и т.д.
В рамках метода валентных связей структура молекулы CO может быть описана формулой " :C≡O:".
Согласно методу молекулярных орбиталей, электронная конфигурация невозбужденной молекулы CO σ 2
O σ 2
z π 4
x, y σ 2
C . Тройная связь образована σ-связью, образованной за счет σ-связиz и электронов двойного вырождения πx, y соответствуют двум π-связям. Электроны на несвязанном σ-уровнеC -и σO -соответствуют двум парам электронов, одна из которых расположена на атоме углерода, а другая – на атоме кислорода.
Тройная связь делает молекулу CO очень прочной (энергия диссоциации 1069 кДж/моль или 256 ккал/моль, больше, чем у любой другой двухатомной молекулы) и имеет небольшое межъядерное расстояние ( dC≡O = 0,1128 нм или 1,13 Å).
Молекула слабо поляризована, ее электрический дипольный момент μ = 0,04⋅10 -29 К м . Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C – ←O+ (направление дипольного момента в молекуле противоположно предполагаемому ранее). Энергия ионизации равна 14,0 эВ, силовая постоянная связи равна k = 18,6 .
Свойства
Оксид углерода(II) – бесцветный газ без запаха и вкуса. Он легко воспламеняется. Так называемый "запах угарного газа" на самом деле является запахом органических загрязнителей.
| Стандартная энергия Гиббса образования ΔG | -137,14 кДж/моль (г) (при 298 K) |
| Стандартная энтропия образования S | 197,54 Дж/моль-К (г) (при 298 К) |
| Стандартная молярная теплоемкость Cp | 29,11 Дж/моль-К (г) (при 298 К) |
| Энтальпия плавления ΔHpl | 0,838 кДж/моль |
| Энтальпия кипения ΔHкипение | 6,04 кДж/моль |
| критическая температура tкритическая температура | -140,23 °C |
| Критическое давление Pкритическое давление | 3,499 МПа |
| Критическая плотность ρкритическая плотность | 0,301 г/см³. |
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатной температуре СО неактивен, его химическая активность значительно возрастает при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других металлов до металлов уже при комнатной температуре. При нагревании он также восстанавливает другие металлы, например, CO + CuO → Cu + CO2↑Это широко используется в пирометаллургии. Реакция СО в растворе с хлоридом палладия является основой для качественного обнаружения СО, см. ниже.
Окисление СО в растворе часто происходит со значительной скоростью только в присутствии катализатора. При выборе последнего большую роль играет природа окислителя. Так, KMnO4 окисляет CO быстрее всего в присутствии тонко измельченного серебра, K2Cr2O7 – в присутствии солей ртути, KClO3 – в присутствии OsO4. В целом, CO по своим восстановительным свойствам схож с молекулярным водородом.
Физиологические эффекты
Токсичность
Монооксид углерода очень токсичен.
TLV (пороговая концентрация, США): 25 ppm ; 29 мг/м3 (как TWA – среднесуточная концентрация, США) (ACGIH 1994-1995). ПДК (предельно допустимая концентрация, США): 30 ppm ; 33 мг/м3 ; Беременность: B (неблагоприятное воздействие возможно даже при уровне ПДК) (1993). ПДКр.с. GN Hygiene Standards 2.2.5.1313-03 составляет 20 мг/м3 (около 0,0017%).
В выхлопных газах бензиновых автомобилей допускается до 1,5-3% (допустимая концентрация значительно варьируется в зависимости от страны/используемых стандартов; а 3% – это много даже для старого карбюраторного автомобиля без каталитического нейтрализатора).
Моноксид углерода(II) классифицируется ООН как класс опасности 2.3, вторичный класс опасности 2.1.
Угарный газ очень опасен, поскольку не имеет запаха и вызывает отравление и даже смерть. Симптомы отравления: головная боль и головокружение; шум в ушах, одышка, учащенное сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжелых случаях судороги, потеря сознания, кома.
Токсическое действие угарного газа обусловлено образованием карбоксигемоглобина – гораздо более прочного карбонильного комплекса с гемоглобином по сравнению с комплексом гемоглобин-кислород (оксигемоглобин). Таким образом, блокируется транспорт кислорода и клеточное дыхание. Концентрация CO в воздухе, превышающая 0,1%, приводит к смерти в течение часа.
Эксперименты на молодых крысах показали, что концентрация 0,02% CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой.
Помощь при отравлении угарным газом(II)
Соединение угарного газа с гемоглобином является обратимым. В случае отравления рекомендуются следующие меры:
- Пострадавшего следует вынести на свежий воздух. В случае легкого отравления достаточно гипервентиляции легких кислородом.
- Искусственная вентиляция легких, O2-терапия, включая гипербарическую камеру.
- Ацизол, хромосома внутривенно.
Встречается в природе.
Этот газ является естественным и постоянным компонентом атмосферы Земли, его концентрация колеблется от 0,01 до 0,9 мг на кубический метр воздуха. Если вам трудно определить, много это или мало, сравните: кубический метр воздуха весит около 1293 граммов, и если угарного газа в нем 0,9 миллиграмма, то его процентное содержание составляет около 0,00007% (для сравнения, водорода в воздухе 0,00008% по весу). При такой концентрации он не будет вреден для организма.
Откуда берется угарный газ в атмосфере? Существуют природные и антропогенные (т.е. связанные с деятельностью человека) источники.
- растения,
- животные (включая человека),
- микроорганизмы,
- вулканические газы,
- болотный газ,
- природные лесные пожары
- и т.д.
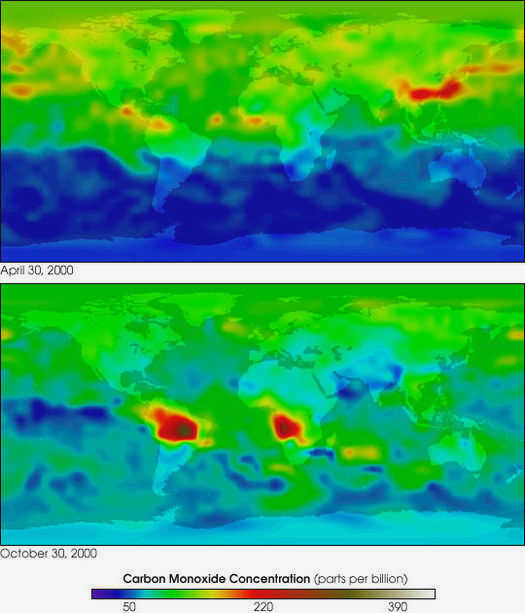
Например, в результате деятельности планктона и водорослей с поверхности океана в атмосферу ежегодно выбрасывается около 220 000 000 тонн СО.
Человеческий организм также выделяет угарный газ в результате биохимических реакций – около 10 мл в день.
Основным источником антропогенного угарного газа в атмосфере являются выхлопные газы автомобилей. Они выделяют около 60%. Содержание угарного газа в выхлопных газах автомобиля не должно превышать 3%, но, положа руку на сердце, как часто соблюдается эта цифра? Из-за неисправностей двигателя он может достигать 10-12%.
Как ведет себя угарный газ в организме
Давайте начнем с того, откуда берется угарный газ в организме, те 10 мл, о которых я говорил выше? В широком смысле, это один из продуктов реакции превращения гемоглобина в билирубин. Затем он связывается с гемоглобином в крови и вместе с углекислым газом переносится в легкие, чтобы покинуть их при выдохе.
Теперь немного больше о гемоглобине. Он состоит из ионов двухвалентного железа, через которые транспортируется кислород, поступающий в организм с воздухом. Именно гемоглобин в крови переносит кислород к тканям организма, чтобы они могли нормально функционировать.
Проблема, однако, заключается в том, что угарный газ присоединяется к гемоглобину, который во много раз легче кислорода. Поэтому, если в воздухе избыток угарного газа, он эффективно конкурирует с кислородом и захватывает гемоглобин, не позволяя кислороду присоединиться к нему. В результате образуется вещество, называемое карбоксигемоглобином. Он настолько силен, что при длительном вдыхании угарного газа накапливается в крови, вытесняя кислород.

Карбоксигемоглобин имеет ярко-красный цвет, поэтому кожа человека становится красной, а кровь и внутренние ткани организма приобретают вишнево-красный цвет. Таким образом, во время вскрытия (если произошла смерть) сразу становится ясно, от чего умер человек.
Это то, что я называю "хождением на цыпочках", говоря о том, как угарный газ накапливается в организме и человек постепенно задыхается. Надеюсь, это было более-менее понятно.
Более того, угарный газ воздействует не только на гемоглобин. Мышечный белок миоглобин также содержит ионы железа. Окись углерода соединяется с ними, образуя карбоксимиоглобин. Конечно, не так легко, как при наличии гемоглобина в крови, но все же достаточно, чтобы человек почувствовал мышечную слабость, что является одним из симптомов отравления.
Моноксид углерода
Моноксид углерода – CO (угарный газ) – это смертельный и коварный яд, который связывается с гемоглобином крови гораздо сильнее, чем живительный кислород. Это бесцветный, безвкусный и не имеющий запаха ядовитый газ (при нормальных условиях). Его химическая формула – CO. Смерть наступает, когда угарный газ уже соединился с 80% гемоглобина. Угарный газ можно обнаружить (до 12%) в выхлопных газах автомобилей.
Основными типами химических реакций, в которых участвует угарный газ, являются реакции присоединения и окисления-восстановления, в которых он проявляет восстановительные свойства.
Угарный газ неактивен при комнатной температуре, но его химическая активность значительно возрастает при нагревании и в растворах. Например, в растворе он восстанавливает Au, Pt, Pd и другие соли до металлов уже при комнатной температуре. При нагревании он также восстанавливает другие металлы, например, CO + CuO = Cu + CO2. Это широко используется в пирометаллургии. Реакция CO в растворе с хлоридом палладия лежит в основе метода качественного обнаружения угарного газа.
Интересно, что существуют бактерии, способные получать энергию, необходимую для жизни, путем окисления СО.
Как уже упоминалось, угарный газ очень опасен. Симптомы отравления: головная боль и головокружение; шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжелых случаях судороги, потеря сознания, кома.
Известны случаи, когда неосторожные водители оставались на ночь в автомобиле, который зимой был припаркован в гараже с закрытой дверью. Чтобы согреться для сна, они включали двигатель, который работал на холостом ходу. Как правило, в гараже скапливался угарный газ, и такие беспечные люди погибали. Автор одной книги справедливо заметил, что "запуск двигателя в маленьком гараже с закрытой дверью – это самоубийство".
Формула угарного газа
Многие люди с детства знакомы с выражением "угарный газ". Это неудивительно, ведь нам приходится сталкиваться с ним каждый день – не только в большом городе (вдоль оживленных дорог, возле газовых плит и колонок), но и в сельской местности (вдоль автострад, в банях и домах, отапливаемых плитами). Небольшой концентрации угарного газа в воздухе – всего 0,1% – достаточно, чтобы вызвать отравление.
Химическая формула угарного газа – CO. Это угарный газ, чрезвычайно летучий и очень ядовитый. Он не имеет ни цвета, ни запаха, что делает его особенно опасным, поскольку его трудно обнаружить человеку. Утечку угарного газа в доме можно обнаружить только после появления первых симптомов отравления угарным газом, а это очень плохо. Дело в том, что отравление проходит незаметно и быстро, а иногда бывает слишком поздно для каких-либо попыток спасения, так как угарный газ может просто "отключить" сознание человека в течение нескольких секунд.
Основное воздействие угарного газа на организм человека заключается в связывании гемоглобина в красных кровяных тельцах (эритроцитах). Действуя как сильный яд, он перекрывает путь кислорода к клеткам, и организм просто не может продолжать функционировать.
Симптомы отравления угарным газом
1,2% – это критический уровень содержания CO в воздухе, при котором сознание немедленно отключается и смерть наступает менее чем через 3 минуты.
Если вы находитесь в закрытом помещении и чувствуете внезапное помутнение сознания, ухудшение слуха и зрения, головную боль, стук в висках и неспособность сосредоточиться – будьте бдительны, в вашем организме наверняка присутствует угарный газ. Немедленно покиньте помещение, выведите всех находящихся в нем людей на свежий воздух и, если возможно, откройте все имеющиеся окна и двери для обеспечения вентиляции.
Конечно, существуют концентрации углекислого газа в воздухе, которые не вызывают острого отравления и не являются внезапным поводом для паники. Однако многие жители мегаполисов, подолгу находясь в местах скопления углекислого газа, жалуются на плохое самочувствие, частые мигрени, нарушения сна, раздражительность, плохую концентрацию внимания.
