Реакция очень чувствительна. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Монооксид углерода
Монооксид углерода (лат. Монооксид углерода Другие названия монооксид углерода, монооксид углерода, монооксид углерода, монооксид углерода) – это бесцветный, безвкусный и не имеющий запаха газ. Его химическая формула – CO.
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
классификация ООН
- Класс опасности ООН 2.3
- Вторичные опасности Классификация ООН 2.1
Молекулярная структура
Молекула CO, как и ее изоэлектронный азотный аналог, имеет тройную связь. Поскольку эти молекулы имеют сходную структуру, то и свойства их похожи – очень низкие температуры плавления и кипения, сходные стандартные значения энтропии и т.д.
В рамках метода валентных связей структура молекулы CO может быть описана формулой :C≡O:, где третья связь образуется по донорно-акцепторному механизму, где углерод является акцептором электронных пар, а кислород – донором.
Согласно методу молекулярных орбиталей, электронная конфигурация невозбужденной молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образуется σ-связь образована σz и электронами двойного вырожденного уровня πx, y соответствуют двум σ-связям. Электроны на σ-связяхC-и σO-связи соответствуют двум парам электронов, одна из которых расположена на атоме углерода, а другая – на атоме кислорода.
Благодаря тройной связи молекула CO очень прочная (энергия диссоциации составляет 1069 кДж/моль или 256 ккал/моль, что больше, чем для любой другой двухатомной молекулы) и имеет небольшое межъядерное расстояние (dC≡O=0,1128 нм или 1,13 Å).
Молекула слабо поляризована, ее электрический дипольный момент μ = 0,04-10 -29 К м (направление дипольного момента O – →C+ ). Потенциал ионизации составляет 14,0 В, константа силы связи k = 18,6.
Молекулярная структура
Молекула CO, как и изоэлектронная молекула азота, имеет тройную связь. Поскольку эти молекулы имеют сходную структуру, они также обладают сходными свойствами – очень низкие температуры плавления и кипения, сходные стандартные значения энтропии и т.д.
Согласно методу валентных связей, структура молекулы CO может быть описана формулой: C≡O:, где третья связь образуется по донорно-акцепторному механизму, где углерод является акцептором электронных пар, а кислород – донором.
Согласно методу молекулярных орбиталей, электронная конфигурация невозбужденной молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образуется σ-связь образована σz и электроны двойного вырожденного уровня πx, y соответствуют двум σ-связям. Электроны на σ-связяхC-и σO-связи соответствуют двум парам электронов, одна из которых расположена на атоме углерода, а другая – на атоме кислорода.
Благодаря тройной связи молекула CO очень прочная (энергия диссоциации составляет 1069 кДж/моль или 256 ккал/моль, что больше, чем для любой другой двухатомной молекулы) и имеет небольшое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, ее электрический дипольный момент μ = 0,04-10 -29 К м (направление дипольного момента O – →C+ ). Потенциал ионизации составляет 14,0 В, константа силы связи k = 18,6.
История открытия
Угарный газ был впервые получен французским химиком Жаком де Лассоном в 1776 году путем нагревания оксида цинка с углеродом, но сначала его приняли за водород, поскольку он горел синим пламенем. Тот факт, что этот газ состоит из углерода и кислорода, был открыт в 1800 году английским химиком Уильямом Круикшанком. Впервые угарный газ за пределами земной атмосферы был обнаружен бельгийским ученым М. Мигеоттом в 1949 году благодаря наличию основной колебательно-вращательной полосы в инфракрасном спектре Солнца.
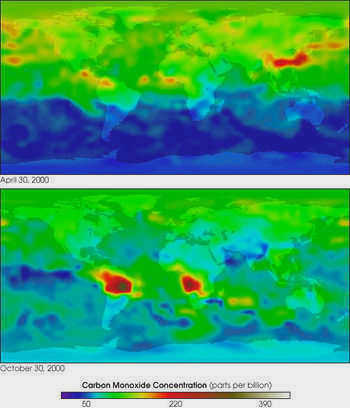
Различают естественный и антропогенный вклад в атмосферу Земли. В природных условиях на поверхности Земли CO образуется в результате неполного анаэробного разложения органических соединений и сжигания биомассы, в основном во время лесных и степных пожаров. В почве угарный газ образуется как биологическим (выделяется живыми организмами), так и небиологическим путем. Экспериментально доказано, что монооксид углерода выделяется фенольными соединениями, часто встречающимися в почвах, содержащими группы OCH3 или OH группы в орто- или пара-положении относительно первой гидроксильной группы.
Общий баланс небиологического производства СО и его окисления микроорганизмами зависит от конкретных условий окружающей среды, в первую очередь от содержания влаги и значения рН. Например, из сухих почв угарный газ выделяется непосредственно в атмосферу, создавая тем самым локальные максимальные концентрации этого газа.
В атмосфере CO является продуктом реакционных цепочек с участием метана и других углеводородов (в основном изопрена).
Основным антропогенным источником CO в настоящее время являются выхлопные газы двигателей внутреннего сгорания. Монооксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточной температуре или при плохо отрегулированной подаче воздуха (поступает недостаточное количество кислорода для окисления CO2). В прошлом значительная часть антропогенных выбросов СО в атмосферу приходилась на газ накаливания, который использовался для освещения помещений в XIX веке. По своему составу он примерно соответствовал водяному газу, то есть содержал до 45% угарного газа. Сегодня этот газ заменен гораздо менее токсичным природным газом (низшие гомологи алканового ряда – пропан и т.д.).
История открытия
Угарный газ был впервые получен французским химиком Жаком де Лассоном в 1776 году путем нагревания оксида цинка с древесным углем, но первоначально был принят за водород, поскольку горел синим пламенем. Тот факт, что этот газ содержит углерод и кислород, был открыт в 1800 году английским химиком Уильямом Круикшанком. Впервые угарный газ за пределами земной атмосферы был обнаружен бельгийским ученым М. Мигеоттом в 1949 году благодаря наличию основной колебательно-вращательной полосы в инфракрасном спектре Солнца.

Различают естественный и антропогенный вклад в атмосферу Земли. В природных условиях на поверхности Земли CO образуется в результате неполного анаэробного разложения органических соединений и сжигания биомассы, в основном во время лесных и степных пожаров. Угарный газ образуется в почве как биологическим (выделяется живыми организмами), так и небиологическим путем. Экспериментально доказано, что угарный газ выделяется фенольными соединениями, часто встречающимися в почве, содержащими группы OCH3 или OH-группы в орто- или пара-положении относительно первой гидроксильной группы.
Общий баланс небиологического производства СО и его окисления микроорганизмами зависит от конкретных условий окружающей среды, в основном от содержания влаги и значения рН. Например, из сухих почв угарный газ выделяется непосредственно в атмосферу, создавая тем самым локальные максимальные концентрации этого газа.
В атмосфере СО является продуктом реакционных цепочек с участием метана и других углеводородов (в основном изопрена).
В настоящее время основным антропогенным источником CO являются выхлопные газы двигателей внутреннего сгорания. Монооксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточной температуре или при плохо отрегулированной подаче воздуха (поступает недостаточное количество кислорода для окисления CO2). В прошлом большая часть антропогенного CO поступала в атмосферу из легкого газа, который использовался для освещения в 19 веке. Он имел тот же состав, что и водяной газ, т.е. содержал до 45% угарного газа. В настоящее время в коммунальном хозяйстве его заменил гораздо менее токсичный природный газ (пропан и т.д.), который содержит меньше всего алканов.
Источник
Промышленный метод
1. Образуется при сжигании угля или соединений на основе углерода (например, бензина) в условиях недостатка кислорода:
2C + O2 → 2CO↑ (тепловой эффект этой реакции составляет 22 кДж),
2. или при восстановлении углекислого газа раскаленным углеродом:
CO2 + C ↔ 2CO↑ (ΔH=172 кДж, ΔS=176 Дж/К).
Эта реакция часто происходит в топке, когда заслонка закрывается слишком рано (до того, как уголь окончательно прогорит). Образующийся угарный газ в силу своей токсичности вызывает физиологические расстройства ("угарный газ") и даже смерть (см. ниже), отсюда и одно из тривиальных названий – "угарный газ". Картина реакций, происходящих в печи, показана на схеме ниже.
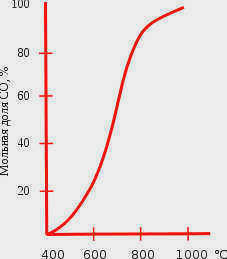
Реакция восстановления углекислого газа является обратимой, и влияние температуры на равновесное состояние этой реакции показано на диаграмме. Течение реакции вправо обеспечивается энтропийным фактором, а влево – энтальпийным фактором. При температуре ниже 400°C равновесие почти полностью смещено влево, а выше 1000°C – вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому угарный газ достаточно стабилен в обычных условиях. Такое равновесие называется будуарное равновесие.
3. Смеси угарного газа с другими веществами получаются при пропускании воздуха, пара и т.д. через слой раскаленного кокса, угля, бурого угля и т.д. (см. генераторный газ, водяной газ, смешанный газ). (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
лабораторный метод
1. Разложение жидкой муравьиной кислоты горячей концентрированной серной кислотой или пропусканием муравьиной кислоты через оксид фосфора P2O5. Схема реакции:
Биологическое воздействие на организм
Как уже говорилось выше, угарный газ – это очень ядовитое, бесцветное, опасное и смертельно опасное для человеческого организма вещество. И не только человеческого, но и всех живых существ. Растения, подвергающиеся воздействию автомобильных выхлопов, очень быстро погибают.
В чем именно заключается биологическое действие угарного газа на внутреннюю среду животных организмов? Оно заключается в образовании прочных комплексных соединений белка крови гемоглобина и вышеупомянутого газа. Это означает, что вместо кислорода захватываются молекулы яда. Клеточное дыхание немедленно блокируется, газообмен нормальным путем становится невозможным.
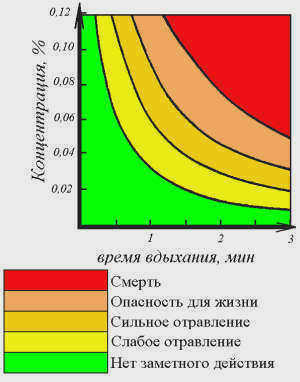
В результате происходит постепенная блокировка всех молекул гемоглобина и, как следствие, смерть. Для того чтобы отравление закончилось смертью, достаточно уровня повреждения всего в 80%. Для этого концентрация угарного газа в воздухе должна составлять 0,1%.
Первыми симптомами, определяющими начало отравления этим соединением, являются:
- головная боль
- головокружение;
- потеря сознания.
Первая помощь заключается в том, чтобы выйти на свежий воздух, где угарный газ будет преобразован кислородом в углекислый газ, то есть нейтрализован. Смертельные случаи от рассматриваемого вещества очень распространены, особенно в домах с печным отоплением. Ведь при сжигании дров, угля и других видов топлива в качестве побочного продукта непременно образуется этот газ. Очень важно соблюдать правила безопасности, чтобы защитить жизнь и здоровье человека.
Также много случаев отравления в гаражах, где установлено много работающих двигателей автомобилей, но нет достаточного притока свежего воздуха. Если концентрация слишком высока, смерть наступает в течение часа. Физически невозможно почувствовать присутствие газа, так как он не имеет ни запаха, ни цвета.

Промышленное использование
В металлургической промышленности монооксид углерода часто используется в реакциях восстановления металлов из их оксидов или солей. Формула получаемого соединения – CO2. При этом образуется чистое металлическое вещество.
Монооксид углерода также используется
- для обработки мясных и рыбных продуктов с целью придания им свежего вида;
- для синтеза некоторых органических соединений;
- в качестве компонента генераторного газа.
Таким образом, это вещество не только вредно и опасно, но и очень полезно для людей и их хозяйственной деятельности.
