Оксиды меди (II) и никеля (II) также восстанавливаются под действием оксида углерода:

Кислород: химия кислорода
Кислород содержится в Основной подгруппе группы VI (или группе 16 в современной форме ETS) и во втором периоде второй период периодической таблицы химических элементов Д.И. Менделеева.
Электронная конфигурация кислорода в основное состояние :
+8O 1s 2 2s 2 2p 4 1s  2s
2s  2p
2p 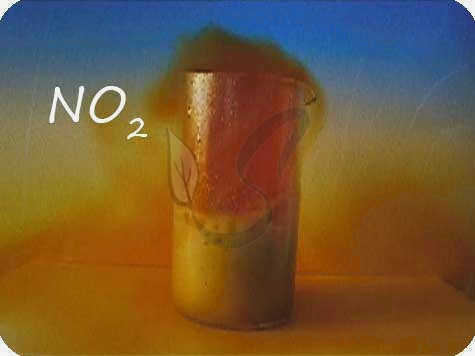
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные пары электронов в основном энергетическом состоянии.
Физические свойства и встречаемость в природе
Кислород O2 – бесцветный, безвкусный и не имеющий запаха газ, немного тяжелее воздуха. Слегка растворим в воде. Жидкий кислород представляет собой голубоватую жидкость, кипящую при температуре -183 o C.
Озон O3 – это голубой газ со специфическим запахом, состоящий из трех атомов кислорода.
Кислород – является самым распространенным элементом в земной коре. Кислород является компонентом многих минералов, таких как силикаты, карбонаты и т.д. Массовая доля элементарного кислорода в земной коре составляет около 47%. Массовая доля элементарного кислорода в морской и пресной воде составляет 85,82%.
Свободный кислород в атмосфере составляет 20,95% по объему и 23,10% по массе.
Углерод
Углерод, неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей составной частью всех органических веществ в природе.

Общая характеристика элементов группы IVa
От C к Pb (сверху вниз по периодической таблице) увеличиваются: атомный радиус, металлические, основные, восстановительные свойства. Электроотрицательность, энергия ионизации и сродство к электрону уменьшаются.
Углерод и кремний – неметаллы, а германий, олово и свинец – металлы.

- C – 2s 2 2p 2
- Si – 3s 2 3p 2
- Ge – 4s 2 4p 2
- Sn – 5s 2 5p 2
- Pb – 6s 2 6p 2
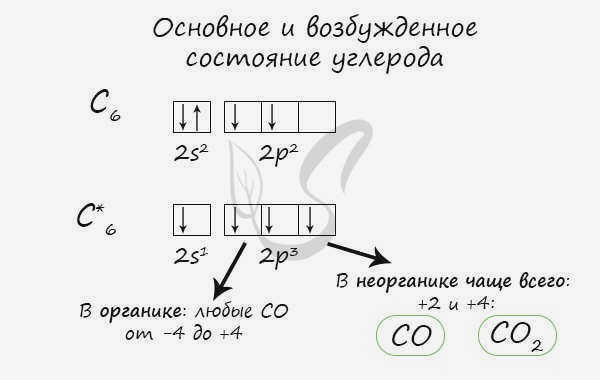
Природные соединения
- Аллотропные модификации – графит, алмаз, фуллерен
- MgCO3 – магнезит
- CaCO3 – кальцит (мел, мрамор)
- CaCO3*MgCO3 – доломит

Получение
Углерод получают путем пиролиза углеводородов (пиролиз – это нагревание без доступа кислорода). Он также используется в производстве соединений углерода: древесины и угля.
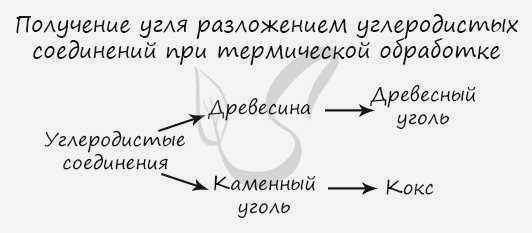
Химические свойства
- Реакции с неметаллами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2C + O2 → (t) 2CO (монооксид углерода – продукт неполного окисления углерода, вызванного отсутствием кислорода)
C + O2 → (t) CO2 (двуокись углерода – продукт полного окисления углерода при наличии достаточного количества кислорода)
Кислород
Кислород (лат. Oxygenium) – элемент группы VIa периода 2 периодической таблицы Д. Менделеева. Он первым открывает группу халькогенидов – элементов группы VIa.
Он бесцветен, не имеет запаха и составляет 21% воздуха.

Общая характеристика элементов группы VIa
Общее название элементов O, S, Se, Te, Po в группе VIa – халькогениды. Халькогениды (греч. χαλκος – руда + γενος – порождающий) входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) увеличиваются: атомный радиус, металлические, основные, восстановительные свойства. Электроотрицательность, энергия ионизации и сродство к электрону уменьшаются.
Среди элементов группы VIa O, S и Se – неметаллы. Элементы группы Po являются металлами.
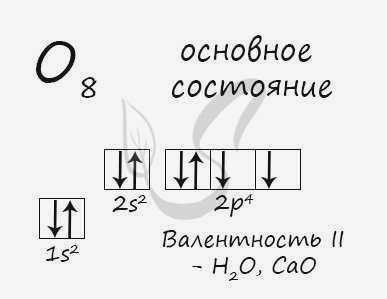
- O – 2s 2 2p 4
- S – 3s 2 3p 4
- Se – 4s 2 4p 4
- Te – 5s 2 5p 4
- Po – 6s 2 6p 4
Основное состояние атома кислорода
Атом кислорода (как и атомы азота, фтора и неона) не имеет возбужденного состояния, поскольку нет свободной орбитали с более высоким энергетическим уровнем, на которую могли бы перейти валентные электроны.
Атом кислорода имеет два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух – кислород составляет 21% воздуха (эта цифра пригодится при решении задач!).
- Земная кора содержит около 50% кислорода в виде различных минералов.
- В живых организмах кислород является компонентом органических соединений, таких как белки, жиры, углеводы и нуклеиновые кислоты.
Приобретение
В промышленности кислород получают из сжатого воздуха. Также широко используются кислородные установки, мембрана которых выполнена в виде фильтра, отсеивающего кислород (мембранная технология).
Резюме
Мы перечислили большинство химических реакций, в которых используется CO.2. Ученые всего мира пытаются решить проблему повышения концентрации углекислого газа в воздухе не без помощи реакций с другими известными химикам веществами. А какие химические формулы воздействия углекислого газа вы знаете?







Спасибо, что указали на ошибку. Исправлено.
В производстве углекислого газа мы заменили старый охладитель углекислого газа с трубками из нержавеющей стали на компрессорном блоке на новый с латунными трубками. Это означает, что на входе в эти трубки охладителя углекислый газ будет иметь давление 16 бар и температуру 130 градусов, на выходе + 10 градусов, и все это с выбросом конденсата. Не произойдет ли в зоне взаимодействия углекислого газа, латуни и воды какая-то непредвиденная реакция? Охладитель работает хорошо, но не будут ли трубки повреждены коррозией?
Прежде всего, нужно выяснить, откуда поступает углекислый газ, какие еще газы попадают в охладитель вместе с углекислым газом. В нашем энергетическом производстве в некоторой части пароводяного тракта, где нагревается теплоноситель, имеются латунные трубки. Мы измеряем растворенный кислород в конденсате перед тем, как он попадает в радиаторы с латунными трубками. В нашем случае высокая концентрация кислорода в воде при нагревании вызывает коррозию латунных трубок.
Ацетил
Наведите курсор на ячейку элемента для краткого описания.
Для получения подробного описания элемента щелкните на его названии.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH – | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | – | – | Н | Н | Н | |
| F – | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | – | Н | Р | Р |
| Кл – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Бр – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | – | – | – | Н | – | – | Н | – | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| ГС – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | – | Н | ? | Н | Н | ? | М | М | – | Н | ? | ? |
| HSO3 – | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | – | Н | Р | Р |
| HSO4 – | Р | Р | Р | Р | Р | Р | Р | Р | – | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| НЕТ3 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р |
| НЕТ2 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | – | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO – | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | – | Р | Р | Р | Р | Р | Р | Р | – | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
